|
Seit etwa dreitausend Jahren in Indien bekannt, galt der Diamant als mystisches Mineral, und er behielt seine hohe Wertschätzung als König der Edelsteine bis heute. Er wird im allgemeinen anerkannt als der Edelstein mit den höchsten Preisen und repräsentierte die höchste Wertkonzentration auf kleinstem Raum. Ein Beispiel dafür (neben vielen anderen) ist ein roter Rohdiamant von 1,75 ct (Karat = 0,2 g), der 1997 auf einer Auktion von Christies in Genf für $805.000,- verkauft wurde. Die rund 24 Tonnen Naturdiamant, die z.Z. jährlich gefördert werden, repräsentieren einen Produktionswert von sechs bis sieben Milliarden Dollar. Nur ein Teil davon wird zu Schmuckzwecken verarbeitet, der aber mit einem Wert von einigen Milliarden Dollar pro Jahr einen Anteil von etwa 90 Prozent am Weltumsatz der Edelsteinbranche ausmacht. Der größere Rest der geförderten Diamanten findet als wertvoller Hartwerkstoff in der Industrie Verwendung.

Der Grund für die hohe Wertschätzung der Diamanten als Edelstein und Industriemineral sind seine einzigartigen und besonderen physikalischen Eigenschaften. Sie sind in den kristallchemischen (chemischen und kristallographisch-kristallstrukturellen) Eigenschaften begründet, weshalb diese zuerst dargestellt und erläutert werden.
Chemisch ist Diamant reiner Kohlenstoff, C als chemisches Symbol, mit der Ordnungszahl 6 (das sechste Element im Periodensystem) und demzufolge sechs Elektronen (1s2 2s2 2p1x 2p1y = je zwei gepaarte s-Elektronen in der ersten und zweiten Schale und zwei p-Elektronen mit ungepaartem Spin) und einer relativen Atommasse (Atomgewicht) von 12. Der Diamant ist im Vergleich zum ebenfalls aus Kohlenstoff bestehenden Graphit die unter hohen Drücken (je nach Höhe der Temperatur um 1200°C bei mehreren zehntausend Bar) stabile Modifikation. Seine Bildung vollzog sich unter solchen Bedingungen in basischen Gesteinen (Periclotite = Olivin-Granat-Gesteine und Eklogite = Pyroxen-Granat-Gesteine) des oberen Erdmantels in Tiefen von 200 km und mehr. Das Wachstum der Diamantkristalle in den Gesteinen des Oberen Erdmantels erfolgte zum großen Teil bereits vor über zwei Milliarden Jahren unter geologisch sehr alten und mächtigen Schichten der Erdkruste, den Kratonen. Oft erst in geologisch wesentlich jüngerer Zeit (z.B. vor 100 Millionen Jahren) wurden die Diamanten mit Bruchstücken ihrer Muttergesteine in relativ schmalen Durchschlagsröhren, den sogenannten Pipes, durch gasreiche vulkanische Eruptionen bis an die Erdoberfläche geschossen. Die brekzienartigen Gesteinsfüllungen, überwiegend sind es Kimberlite, sind dann die primären Trägergesteine mit Diamantgehalten von unter 0,2 ct bis teilweise 8 ct pro Tonne Gestein. Das Vorkommen der Diamanten in den sekundären Ablagerungsprodukten aus der Verwitterung der primären Vorkommen, lockere oder verfestigte Sande oder Konglomerate als Seifen, bezeugt deren große Widerstandsfähigkeit. Der Diamant ist chemisch resistent gegenüber Säuren und Basen. Oberhalb 800 - 850°C verbrennt er an der Luft zu Kohlendioxid.
Die Kristallstruktur des Diamanten lässt sich geometrisch so beschreiben, dass die Kohlenstoffatome die Positionen zweier kubisch flächenzentrierter Gitter besetzen, die so ineinander gestellt sind, dass sie um ein Viertel einer Raumdiagonale der Elementarzelle gegeneinander verschoben erscheinen. Die Kohlenstoffatome des zweiten Teilgitters besetzen dabei jeweils die Positionen jeder zweiten tetraedrischen Lücke des ersten Teilgitters und umgekehrt. Alle Kohlenstoffatome werden somit gleichermaßen tetraedrisch von vier nächsten Nachbaratomen koordiniert. Aus der Kristallstruktur folgen die kubische hexakisoktaedrische Kristallklasse m3m und die Raumgruppe Fd3m.
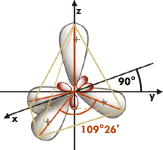 Die Winkel zwischen den Verbindungslinien zu benachbarten Atomen (Bindungswinkel) ergeben sich sowohl geometrisch aus der Kristallstruktur als auch aus den Orbitalen (Bahnen) der vier Elektronen der zweiten Schale in den Kohlenstoffatomen, die in Form der sp3 - Hybridisierung (ein gepaartes s-Elektron mutiert zu einem ungepaarten p-Elektron) vorliegen, zu 109°28', dem Tetraederwinkel (= dem Doppelten des Winkels zwischen Raumdiagonale und Kante des Würfels) Die Winkel zwischen den Verbindungslinien zu benachbarten Atomen (Bindungswinkel) ergeben sich sowohl geometrisch aus der Kristallstruktur als auch aus den Orbitalen (Bahnen) der vier Elektronen der zweiten Schale in den Kohlenstoffatomen, die in Form der sp3 - Hybridisierung (ein gepaartes s-Elektron mutiert zu einem ungepaarten p-Elektron) vorliegen, zu 109°28', dem Tetraederwinkel (= dem Doppelten des Winkels zwischen Raumdiagonale und Kante des Würfels)
 Nähme man an, dass sich die Kohlenstoffatome als starre Kugeln eben berühren, so würde eine sehr geringe Packungsdichte von nur 34% resultieren. Da sich die Bindungsorbitale der Atome jedoch kalottenartig überlappen, ergibt sich für die Diamantstruktur eine Raumausfüllung von über 90% mit einer sehr starken kovalenten Bindung, aus der sich einige einzigartige Eigenschaften, wie z.B. die extreme Härte, ableiten lassen. Aus der Gitterkonstante des Diamant, a = 0,355 nm , mit acht Kohlenstoffatomen pro Elementarzelle, folgt ein Abstand von 0,154 nm zwischen den Mittelpunkten benachbarter Atome. Nähme man an, dass sich die Kohlenstoffatome als starre Kugeln eben berühren, so würde eine sehr geringe Packungsdichte von nur 34% resultieren. Da sich die Bindungsorbitale der Atome jedoch kalottenartig überlappen, ergibt sich für die Diamantstruktur eine Raumausfüllung von über 90% mit einer sehr starken kovalenten Bindung, aus der sich einige einzigartige Eigenschaften, wie z.B. die extreme Härte, ableiten lassen. Aus der Gitterkonstante des Diamant, a = 0,355 nm , mit acht Kohlenstoffatomen pro Elementarzelle, folgt ein Abstand von 0,154 nm zwischen den Mittelpunkten benachbarter Atome.
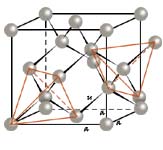
In den sieben in der hexakisokteaedrischen Kristallklasse möglichen einfachen Formen ist das Oktaeder {111} die häufigste Wachstumsform der Diamantkristalle. Das lässt sich, wie auch die gute Spaltbarkeit der Diamantkristalle parallel zu den Oktaederflächen (# nach (111)), durch die analytische Bewertung der Bindungsvektoren aus der Kristallstruktur ableiten. Weitere Formen sind Hexaeder und Dodekaeder, meist auch in Kombination mit dem Oktaeder. Die Kristallflächen und -kanten sind oft gerundet, häufig durch lamellar oder stufenförmig angeordnete Vizinalfläche oder eine anderweitig strukturierte Oberfläche. Die Ursachen hierfür liegen wohl überwiegen in Lösungsvorgängen bei Änderungen der physikochemischen Zustandsbedingungen im Bildungsraum. Typisch dafür sind auf Oktaederflächen (mikroskopisch) oft sichtbare zahlreiche dreieckige Vertiefungen, sogenannte Trigons, und gelegentliche rechteckige Vertiefungen, sogenannte Rectangels, auf Dodekaederflächen. Diese Vertiefungen sind Ätzgrübchen an Austrittspunkten von Versetzungslinien. Ihre Umrisse zeigen die jeweilige Flächensyymetrie an, und ihre Häufigkeit gibt Hinweise auf die Untensität struktureller Defekte im Kristall durch plastische Deformation. Je nach Vorkommen machen sogenannte irregulär geformte Diamanten sowie z.T. polykristalline Aggregate einen höheren Anteil aus. Etwas besonderes stellen die plattig ausgebildeten Diamantkristalle, sogenannte Macles, dar, bei denen es sich um Zwillinge nach dem Spinellgesetz (Zwilling nach (111), Zwillingsebene paralleleiner Oktaederfläche) handelt. Eine sich parallel wiederholende Verzwilligung oder Stapelfehlordnungen nach diesem Gesetz machen die plattige Ausbildung und einen gelegentlichen dreieckigen Umriss dieser Kristalle verständlich.
Von den physikalischen Eigenschaften ist die enorme Härte als einzigartig hervorzuheben; man kennt bisher keinen härteren Stoff. Härte ist physikalisch am einfachsten als „Eindruckhärte” zu definieren, als „Widerstand gegen einen lokalen Eindruck”. In Praxis wird ein harter Indenter, je nach Methode eine Pyramidenspitze oder eine Kugel, auf die Oberfläche mit einer Last W gedrückt, wobei ein permanenter Eindruck mit einer umrissenen Fläche A erzeugt wird. Konventionell ist die Härte H = W/A. So ermittelte Werte für Würfelflächen (100) von Diamanten liegen bei etwa 10 t mm-2 (zum Vergleich: Korund 2t mm-2, Kupfer 40 kg mm-2). Die Härte ist als Kristalleigenschaft grundsätzlich anisotrop (Härteanisotropie), d.h. richtungsabhängig unter Widerspiegelung der Symmetrie der Kristallklasse. Die Eindruckhärte, wie auch die für die Bearbeitung der Diamanten zu facettierten Schmucksteinen wichtigere Schleifhärte, sind auf verschiedenen Flächen (z.B. Würfel {100}, Rhombendodekaeder {110} und Oktaeder {111} unterschiedlich und sind auf diesen Flächen auch noch in den verschiedenen Richtungen unterschiedlich. So ist z.B. der Schleifwiderstand auf einer Rhombendodekaederfläche in Richtung parallel der Längsachse der Fläche (parallel [110]) deutlich verschieden von der dazu senkrechten Richtung (parallel [100]). Auf den Oktaederflächen sind dazu auch noch Richtung und Gegenrichtung unterschiedlich entsprechend der dreizähligen Flächensymetrie. Beim Schleifen mit Diamantpulver werden diese Härteunterschiede möglichst effektiv genutzt.
Das spezifische Gewicht des Diamanten mit 3,52 g cm-3 ist deutlich höher als das von Silicium (2,38 g cm-3) mit der gleichen Kristallstruktur. Es steht im Periodensystem als 14. Element mit einem mehr als doppelt so hohen Atomgewicht in der vierten Gruppe unter dem Kohlenstoff. das macht die beim Diamanten trotz der geometrisch lockeren Viererkoordination die enorm hohe Elektronendichte deutlich, wie bereits bei den Bindungeverhältnissen erläutert.
Die enorme Lichtbrechung, im Mittel liegt der Brechungsindex n bei 2,43, läßt sich ebenfalls damit begründen. Eine zweite optische Eigenschaft ist für den Diamant als Schmuckstein noch von Bedeutung: die Dispersion der Lichtbrechung. Der Brechungsindex ist bei größeren Wellenlängen (z.B. im Roten bei etwa 690 nm) kleiner und bei kleineren Wellenlängen (z.B. im Blauen 480 nm) größer, was bereits bei kleinen prismatisch geneigten Flächen zu einem spektralen Farbenspiel führt. Lichtbrechung und Dispersion ergeben den Glanz und das Feuer der geschliffenen Diamanten. Für die als Schmuck am häufigsten gefertigten Brillianten ist es die Brillianz, hervorgerufen durch die Lichtbrechung (beim Eintritt in den Stein und beim Austritt) und die Reflexion (Oberflächenreflexion und mehrfache Totalreflexion, wellenlängenabhängig bereits bei Einfallswinkeln um 25°, im Steininnern). So entwickelte sich auch der Brilliantschliff in seinen Proportionen um eine optimale Lichtausbeute und hohe Brillianz zu erzielen.
Für die Bewertung eines Schmuckdiamanten werden vier Charakteristika, die vier „C” herangezogen:
- das Gewicht ≡ „C”arat
- die Farbe ≡ „C”olour
- die Reinheit ≡ „C”larity
- der Schliff ≡ „C”ut.
Ist das Gewicht mit hoher präzision schnell zu messen, gibt es für die Beurteilung von Farbe, Reinheit und Schliff bisher kaum leicht handhabbare Messgeräte oder sie sind sehr teuere. Es existiert aber eine Reihe weitgehend ähnlicher Regeln in vielen Ländern, nach denen mit Erfahrung und einigen modernen Geräten die Kriterien richtig bewertet und verläßliche Zertifizierungen erhalten werden können.
Der Diamant besitzt eine Reihe weiterer hervorragender Eigenschaften, die zwar für seine Verwendung als Schmuck weniger von Bedeutung sind, es sei denn man nutzt sie zur Diagnostik, jedoch im „high - tech” - Bereich wichtige und aktuelle Anwendungen finden:
- Sehr hohe Wärmeleitfähigkeit (je nach Typ zwischen 600 und 2200 Wm-1K-1 bei 20°C)
- Sehr hoher elektrischer Widerstand (Isolator >1014 Ωm)
- Breite optische Transparenz (reiner Diamant: zwischen 225 nm - 2,5 µm und oberhalb 6 µm)
- Halbleiter mit sehr großer Energielücke, dotierbar mit Akzeptoren und Donatoren.
|


